Atome Ion
Conducteurs et isolants
Un conducteur est une matière à travers laquelle le courant électrique peut circuler. On dit qu'une telle matière conduit le courant électrique.
Un isolant est une matière à travers laquelle le courant électrique ne peut circuler.
Quelques exemples de conducteurs et d'isolants
Exemples de conducteurs: le fer, l'acier, l'aluminium, l'argent, l'or, le cuivre, le zinc, le plomb, l'étain, le graphite.
Exemples d'isolants: le verre, l'air, le bois, le papier, le tissu, les matières plastiques.
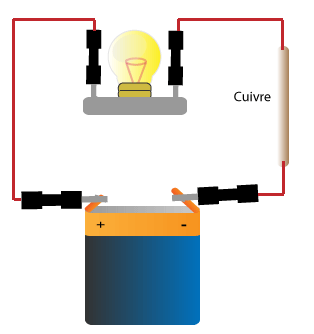
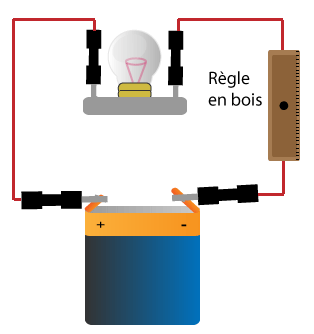
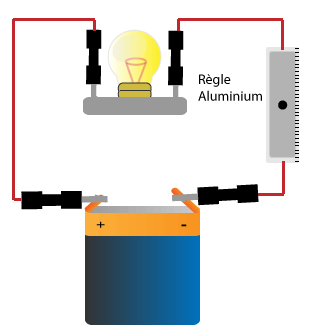
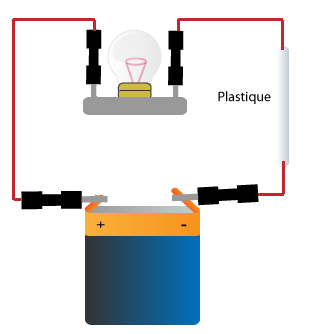 D'une manière générale tous les métaux (fer, or, argent, cuivre, aluminium, zinc etc) sont conducteurs.
D'une manière générale tous les métaux (fer, or, argent, cuivre, aluminium, zinc etc) sont conducteurs.Remarque: Certains liquides sont conducteurs mais ce test n'est pas toujours assez sensible pour détecter les courants qui peuvent y circuler.
Les isolants et les conducteurs dans les circuits électriques
Pour que le courant électrique puisse circuler dans un circuit il faut donc non seulement que celui-ci soit fermé mais aussi qu'il ne soit constitué que d'une succession de matières conductrices.La présence d'un isolant dans la boucle que forme un circuit a un effet comparable à un interrupteur ouvert.
Tous les solides ne conduisent pas le courant électrique. Tous les métaux conduisent le courant électrique.
Structure des métaux
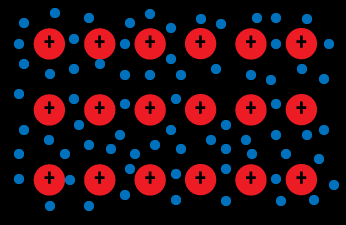 Les électrons périphériques ne sont plus attachés à un atome
Les électrons périphériques ne sont plus attachés à un atomeIls sont délocalisés dans le solide sous forme de nuage qui assure la cohésion
Les électrons sont moins attaché à un atome et circulent librement et de manière aléatoire d’un atome à un autre.
Tous les métaux sont constitués d’un empilement ordonné d’atomes.
Le cuivre
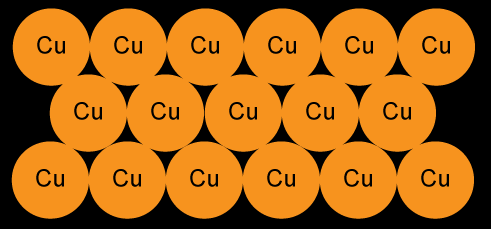 Le cuivre est un empillement régulier et ordonné d'atomes de cuivre.
Le cuivre est un empillement régulier et ordonné d'atomes de cuivre.Si le cuivre est pur, tous les atomes qui le composent sont identique et de même taille.
Le symbole chimique du cuivre est Cu
Tous les métaux sont constitués, comme le cuivre, d’un empilement ordonné d’atomes.
La taille d’un atome est de l’ordre de 135 pico mètre
Structure d’un atome
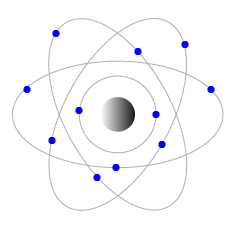 Modèle classique
Modèle classique
 modèle de schrodinger
modèle de schrodinger
L’atome a la forme d’une sphère. Au centre de cette sphère se trouve une particule appelée « noyau », et autour du noyau il y a des particules nommées électrons.
Les électrons sont tous identiques. Selon l’élément chimique (matière), le nombre d’électrons est différent. Le noyau est environ 100 000 fois plus petit que l’atome.
Le noyau d’un atome a une charge électrique positive, tandis que les électrons ont une charge électrique négative.
La charge positive du noyau est exactement compensée par la charge négative des électrons, si bien qu’un atome entier (noyau + électrons) est électriquement neutre.
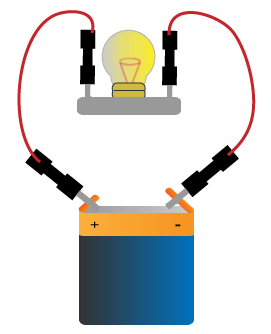 Un circuit électrique constitué d’une pile et d’une lampe, reliées par des fils électriques.
Un circuit électrique constitué d’une pile et d’une lampe, reliées par des fils électriques.Ces fils sont faits de cuivre conducteur, entouré de plastique isolant.
Sous l’effet du potentiel de la pile, les «électrons libres» se déplacent d’atome en atome, en direction de la borne +.
C’est ce mouvement d’ensemble de tous les électrons libres qui constitue le courant électrique.
Les électrons libres, étant de charge négative, sont repoussés par la borne − de la pile, et attirés par sa borne +.
Nature du courant électrique dans les solutions
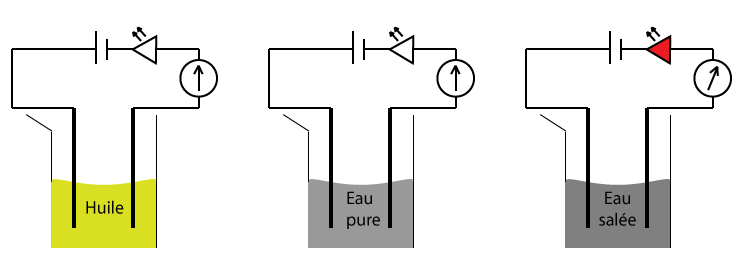
Les solutions aqueuses sont conductrices à condition que les substances dissoutes soient constituées d’ions. C’est le cas du chlorure de sodium (sel de cuisine), ou du sulfate de cuivre, par exemple.
L’eau du robinet contient également des ions mais en très faible quantité.
Les solutions aqueuses qui contiennent ainsi des ions sont appelées «solutions aqueuses ioniques».
Si les substances dissoutes sont faites de molécules, et non pas d’ions, la solution aqueuse n’est pas conductrice. C’est le cas du saccharose (sucre blanc).
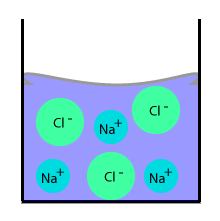 Un ion c’est un atome, ou une molécule, qui a gagné ou perdu un ou plusieurs électrons, et qui par conséquent n’est plus électriquement neutre.
Un ion c’est un atome, ou une molécule, qui a gagné ou perdu un ou plusieurs électrons, et qui par conséquent n’est plus électriquement neutre.L’ion chlorure
Un atome de chlore Cl, possède 17 électrons :
Chaque électron ayant une charge électrique égale à − 1, la charge totale des électrons = − 17.
Le noyau de l’atome de chlore possède, quant à lui, une charge électrique égale à + 17.
Au total la charge électrique de l’atome de chlore est donc nulle (+ 17 − 17 = 0)
Tous les atomes sont électriquement neutres
L’atome de chlore peut facilement capturer un électron supplémentaire à un atome qui peut facilement céder un électron (sodium par exemple). Sa charge totale est maintenant (-18 + 17 = -1). L’atome de chlore devient Cl-
De la même manière, le sodium en perdant un électron en faveur du chlore, devient Na+. La charge totale de la solution est toujours nulle.
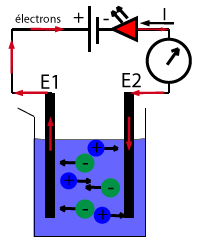 Dans une solution aqueuse ionique, les ions de charge positive sont donc attirés par l’électrode de charge négative, et inversement.
Dans une solution aqueuse ionique, les ions de charge positive sont donc attirés par l’électrode de charge négative, et inversement.
Transformation d’ions en atomes
 Une solution aqueuse de sulfate de cuivre
Une solution aqueuse de sulfate de cuivreCette solution est de couleur bleu azur : ceci est dû à la présence des ions Cu2+.
Laissons passer le courant électrique quelques minutes dans le circuit, puis retirons les électrodes du bécher : on observe alors sur la cathode un dépôt de couleur orangée. C'est la couleur du cuivre.
- La solution contient des ions sulfate, de charge négative, et des ions cuivre (II) de charge positive. Ces derniers sont attirés par la cathode.
- Au contact de la cathode, les ions cuivre (II) récupèrent 2 électrons et se transformes en Cu.
- Les électrons arrivent dans la cathode en provenance du générateur.
- Chaque ion cuivre (II) peut ainsi récupérer 2 électrons et se transformer en atome de cuivre qui se dépose sur la cathode.
- Cu2+ + 2 e- --> Cu
