L’atmosphère terrestre
 Notre planète, la Terre, est entourée d’une couche essentiellement gazeuse: l’atmosphère.
Son principal constituant est l’air, mais qu’elle contient aussi des matières non gazeuses comme par exemple les nuages, faits de petits cristaux de glace (eau à l’état solide) et de gouttelettes (eau à l’état liquide). Il y a également, en suspension dans l’atmosphère, bien d’autres constituants moins visibles que les nuages.
Notre planète, la Terre, est entourée d’une couche essentiellement gazeuse: l’atmosphère.
Son principal constituant est l’air, mais qu’elle contient aussi des matières non gazeuses comme par exemple les nuages, faits de petits cristaux de glace (eau à l’état solide) et de gouttelettes (eau à l’état liquide). Il y a également, en suspension dans l’atmosphère, bien d’autres constituants moins visibles que les nuages.
Plus on s’éloigne de la surface de la Terre, plus l’atmosphère devient « raréfiée ». 99% de la masse totale de l’atmosphère sont contenus dans les 30 premiers kilomètres d’altitude, et les 1 % restant sont étalés sur plusieurs dizaines de kilomètres.
L’air est en réalité un mélange de plusieurs gaz. Les deux principaux sont le diazote (presque 80% de l’air) et le dioxygène (environ 20%). Les autres gaz (quelques % en tout) sont : la vapeur d’eau, l’argon, le dioxyde de carbone, les oxydes d’azote et les oxydes de soufre (gaz polluants produits notamment par les moteurs des véhicules et les activités industrielles)... et bien d’autres encore, en quantités très faibles.
 Les particules en suspension: Il y a d’abord celles que l’on trouve dans les nuages, comme les cristaux de glace et les gouttelettes d’eau. Mais il y a aussi, un peu partout dans l’atmosphère, de minuscules grains de terre ou de sable arrachés par le vent, ainsi que des gouttelettes d’eau salée ou des cristaux de sel provenant de la mer ; il y a aussi des cendres volcaniques, des pollens de plantes, diverses fibres végétales, des grains de suie (provenant des moteurs et des activités industrielles), des poussières et des fumées diverses.
Les fumées sont constituées de particules solides de très petite taille en suspension dans l’air. On trouve aussi des bactéries et des virus dans l’air.
Les particules en suspension: Il y a d’abord celles que l’on trouve dans les nuages, comme les cristaux de glace et les gouttelettes d’eau. Mais il y a aussi, un peu partout dans l’atmosphère, de minuscules grains de terre ou de sable arrachés par le vent, ainsi que des gouttelettes d’eau salée ou des cristaux de sel provenant de la mer ; il y a aussi des cendres volcaniques, des pollens de plantes, diverses fibres végétales, des grains de suie (provenant des moteurs et des activités industrielles), des poussières et des fumées diverses.
Les fumées sont constituées de particules solides de très petite taille en suspension dans l’air. On trouve aussi des bactéries et des virus dans l’air.
De tous les constituants de l’atmosphère, le dioxygène, est sans aucun doute le gaz le plus important, appelé couramment «oxygène». En effet, ce gaz est vital, c’est-à-dire indispensable à la vie de très nombreux organismes. Le dioxygène passe dans le sang et circule dans tout notre corps. Là, il participe à des réactions chimiques qui libèrent des substances et de l’énergie indispensables au fonctionnement de nos organes.
L’air est constitué de molécules
Si on néglige les autres gaz, l’air est constitué de 80% de diazote et 20% de dioxygène. Ce sont des particules extraordinairement petites, mille fois plus petites que les bactéries ou les virus : les molécules.
 Sur 10 molécules, il y a 8 molécules de diazote et 2 de dioxygène : on retrouve les pourcentages (80% et 20%).
Entre les molécules, il n’y a que le vide.
Les molécules ne sont pas immobiles : elles se déplacent continuellement. Elles rebondissent les unes sur les autres, ou sur les objets qu’elles rencontrent.
Sur 10 molécules, il y a 8 molécules de diazote et 2 de dioxygène : on retrouve les pourcentages (80% et 20%).
Entre les molécules, il n’y a que le vide.
Les molécules ne sont pas immobiles : elles se déplacent continuellement. Elles rebondissent les unes sur les autres, ou sur les objets qu’elles rencontrent.
 La molécule de dioxygène est un assemblage de deux sphères. Chacune de ces sphères est un atome d’oxygène. Les couleurs ne sont que symbolique.
Le préfixe di- signifie qu’il y a deux atomes d’oxygène assemblés.
L’atome d’oxygène s’écrit par la lettre O. Et comme la molécule est faite de deux atomes d’oxygène, on l’écrit en abrégé O2. La formule de la molécule de dioxygène est O2.
La lettre O est écrite en majuscule, et le chiffre 2 est écrit à droite et en bas de la lettre O, en indice.
La molécule de dioxygène est un assemblage de deux sphères. Chacune de ces sphères est un atome d’oxygène. Les couleurs ne sont que symbolique.
Le préfixe di- signifie qu’il y a deux atomes d’oxygène assemblés.
L’atome d’oxygène s’écrit par la lettre O. Et comme la molécule est faite de deux atomes d’oxygène, on l’écrit en abrégé O2. La formule de la molécule de dioxygène est O2.
La lettre O est écrite en majuscule, et le chiffre 2 est écrit à droite et en bas de la lettre O, en indice.
L'air est pesant

On avait pesé le ballon de football avant de le dégonfler : sa masse était m1 = 441,7 g. On le pèse ensuite le ballon après lui avoir retiré 1 litre d’air : sa masse est m2 = 440,5 g
1 litre d’air pèse un peu plus de 1 gramme dans les conditions usuelles de température et de pression. Cette valeur est à comparer à celle de 1 litre d’eau liquide, qui vaut environ 1000 grammes.
En conclusion : l’air est environ mille fois plus léger que l’eau liquide.
La masse d’air varie avec la température
Des expériences réalisées à différentes températures ont données les valeurs suivantes
| Température | Masse d'un litre air |
| 0° C | 1,28 g |
| 20° C | 1,20 g |
| 100° C | 0,96 g |
Une augmentation de la température provoque une augmentation de l'espace entre les molécules
Donc, dans un même volume, il y'aurai moins de molécules. Par conséquent la masse d'air diminue avec une augmentation de la température
La pression des gaz
L’unité de pression est légalement le Pascal (Pa) mais il existe deux autres unité : Le bar : 1 bar = 105 Pa

- L’atmosphère : 1 atm = 1013 hPa (valeur de la pression atmosphérique
- La pression atmosphérique est la pression qu’exerce l’air qui nous entoure
- Le baromètre, qui permet de mesurer la pression atmosphérique.
- Le manomètre permet de mesurer la pression d’un gaz dans un récipient par exemple. Généralement il s’agit de manomètre différentiel, ils mesurent la différence entre la pression du gaz dans le récipient et la pression atmosphérique.
On peut mesurer la pression avec deux appareils :
La pression des gaz et les molécules
Quand un pneu de vélo est gonflé à forte pression, il est très dur, car l’air qui est à l’intérieur appuie très fort sur les parois du pneu.
L’air est constitué de minuscules molécules, extrêmement nombreuses, qui bougent sans arrêt, et rebondissent entre elles ou sur les parois des objets qu’elles rencontrent. Ce sont tous ces chocs moléculaires qui font que l’air appuie sur les objets avec lesquels il est en contact, autrement dit qui créent la pression.
Comparons maintenant les molécules dans les trois situations A, B et C.
Le nombre de molécules est limité pour simplifier.
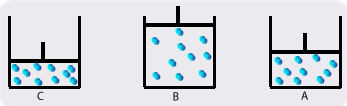 Dans le cas A, les molécules disposent d’un certain volume.
Dans le cas B, on retirant le piston on augmente le volume. Les molécules disposent de plus d’espace, par conséquent le nombre de chocs contre les parois est moins important que précédemment. Pression moins importante.
Dans le cas C, on baissant le piston on réduit le volume. Les molécules sont plus rapprochées et les chocs contre les parois sont fréquents que dans les deux autres cas. Pression plus importante que A et B.
Dans le cas A, les molécules disposent d’un certain volume.
Dans le cas B, on retirant le piston on augmente le volume. Les molécules disposent de plus d’espace, par conséquent le nombre de chocs contre les parois est moins important que précédemment. Pression moins importante.
Dans le cas C, on baissant le piston on réduit le volume. Les molécules sont plus rapprochées et les chocs contre les parois sont fréquents que dans les deux autres cas. Pression plus importante que A et B.
Augmenter la pression d’un gaz sans diminuer son volume
Une augmentation de la température augmentera la mobilité des molécules, par conséquent la fréquence des chocs augmentera. La pression serait donc plus forte.
