La combustion du carbone

La bougie brûle dans l'air
On couvre la bougie avec un bocal, elle s'éteint au bout de quelques secondes
La bougie qui brûle consomme le dioxygène de l'air, elle s'éteint quand elle aura consommé le dioxygène contenu dans le verre. Le dioxygène est indispensable à la combustion de la bougie.Il est indispensable à toute combustion

Pour réaliser une combustion il faut:
- Un combustible, substance capable de brûler (du papier, du bois, du charbon de bois, de l’essence, etc..)
- Une mise à feu (la flamme d’une allumette ou d’un briquet).La mise à feu apporte de la chaleur.
- Un comburant, le dioxygène de quantité suffisante autour de la flamme
Le charbon du bois

Le charbon de bois contient de l'eau, du goudron et quelques substances chimiques
En enflammant le charbon de bois avec une flamme, on ne voit aucune flamme, mais des taches rouges de braise. Ce sont des taches très chaudes.
Il y a incandescence du fait de la température élevée.
Si on souffle sur les braises, l'incandescence devient plus vive.
la quantité de dioxygène dans l’air (20 %) est peut-être insuffisante pour permettre l’inflammation du charbon de bois.
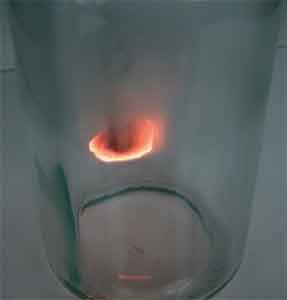
On prépare un flacon de dioxygène pur.
On porte le charbon de bois à incandescence avec une flamme, comme dans l’expérience précédente.
Enfin, on introduit le charbon de bois incandescent dans le flacon
le charbon de bois s’enflamme et la lueur est éblouissante, allant du jaune très clair au rouge-orangé: la combustion a réussi !
- de la buée se dépose sur les parois du bocal.
- au bout d’une dizaine de secondes, la combustion s’arrête (la lueur s’éteint).
- sur le morceau de charbon, on peut voir des cendres blanchâtres.
- les parois du bocal sont chaudes : la combustion a libéré de l’énergie.
Comme dans l’expérience de la bougie, tout le dioxygène a été consommé.
On laisser tomber dans le bocal un papier enflammé : il s’éteint aussitôt donc, il n’y a plus de dioxygène.
Le charbon de bois a diminuer de taille. Une pesée avant et après la combustion nous donne la quantité du charbon de bois qui a disparu.
Les matières apparues
- De la buée (provenant de l'humidité du charbon de bois)
- Des cendres (matières nouvelles)
- Les gaz provenant du flacon de la combustion font troubler l'eau de chaud
Conclusion
Le dioxygène réagit avec le charbon de bois pour donner des cendres et du dioxyde de carbone.Des matières ont disparues (les réactifs), des matières se sont formées (les produits de la réaction).
La combustion du carbone pur

- Dans le carbone pur, il n’y a que des atomes de carbone.
- Le symbole chimique des atomes de carbone est la lettre C.
- Un atome de carbone est représenté avec la couleur symbolique noire.
Quand on fait brûler du carbone pur dans un flacon de dioxygène, la lueur observée est semblable à celle émise par le charbon de bois. Mais, en revanche, il ne se forme ni buée, ni cendres.
À la fin de la combustion, le test à l’eau de chaux est positif.
L’équation chimique de la combustion du carbone pur s’écrit donc:
dioxygène + carbone  dioxyde de carbone
dioxyde de carbone

Carbone +

Dioxygène 

Dioxyde de carbone
La molécule de dioxyde de carbone qui se forme à la fin provient de l’assemblage de l’atome de carbone et des deux atomes d’oxygène présents dans les deux réactifs (dioxygène et carbone).
On retrouve dans le produit de la réaction (dioxyde de carbone) les atomes qui étaient présents dans les réactifs (dioxygène et carbone).
Lors d’une réaction chimique, les atomes présents dans les réactifs s’assemblent pour former de nouvelles molécules qui constituent les produits de la réaction.
On retrouve exactement les mêmes atomes à la fin d’une réaction chimique qu’au début: c'est le principe de la conservation des atomes
La conservation des atomes explique pourquoi la masse des produits de réaction est exactement la même que celle des réactifs
C'est le principe de la conservation de la masse au cours des réactions chimiques.
Une réaction chimique est une transformation de matière, c'est une réorganisation des molécules (atomes ou ions) des réactifs pour produire des nouveaux produits.
Les produits de départ sont appelés les réactifs et les produits obtenus après réaction sont appelés les produits de réaction.
Une réaction chimique peut être complète, disparition des réactifs (mélangés dans les bonnes proportions) pour donner des produits, ou incomplète si après un temps suffisamment lent, il reste toujours des réactifs.
Combustion du méthane
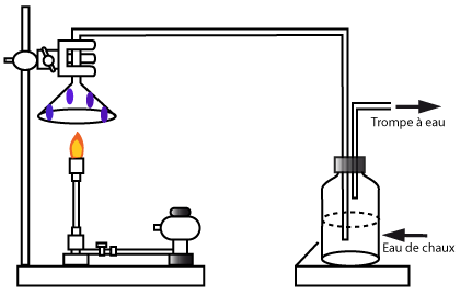
L'apparition des gouttelettes d'eau sur l'entonnoir résulte de la présence d'eau.
L'eau de chaux qui se trouble est du à la présence de dioxyde de carbone.
La réaction du méthane avec le dioxygène produit du dioxyde de carbone et de l'eau.
C'est une réaction de combustion.
Combustion complète
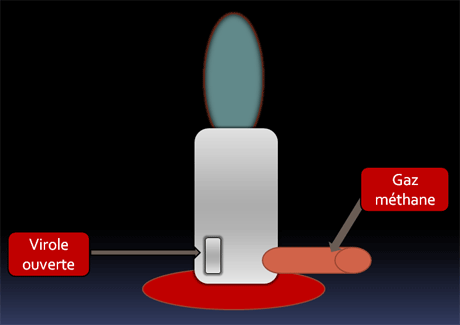
Le méthane est le principal constituant du gaz naturel. Ce dernier est extrait de gisements souterrains (la Russie et le Moyen-Orient, notamment, sont de grands producteurs de gaz naturel).
La virole pleinement ouverte permet l'arrivée d'un excès de dioxygène pour brûler complètement le méthane et le transformer en dioxyde de carbone.
La flamme obtenue est de couleur bleue est chauffante.
Quand la combustion du méthane donne une flamme bleue, on dit que cette combustion est « complète ». Pour que la combustion soit complète, il faut que le dioxygène soit en quantité abondante.
Bilan de la transformation
Méthane + Dioxygène ![]() Dioxyde de carbone + Eau
Dioxyde de carbone + Eau

Combustion incomplète
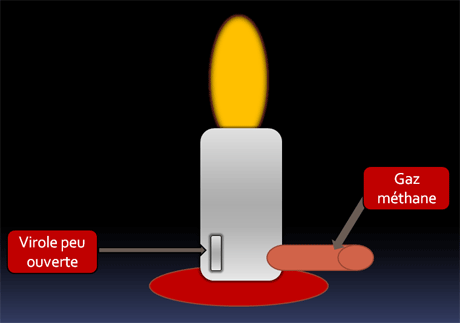
La virole n'est pas suffisamment ouverte et le dioxygène est en défaut. Il n'y en a pas assez pour transformer tout le méthane en dioxyde de carbone.
On obtiendra donc du monoxyde de carbone (gaz toxique) ou du dioxyde de carbone.
La flamme est de couleur jaune et moins brûlante.
